Sul portale internet https://safetymedsim.eu del progetto europeo ‘Simulation Approach For Education and Training in Emergency’ (SAFETY), volto a valutare il divario tra le conoscenze teoriche e pratiche nel settore della medicina d’urgenza e della simulazione, è stato pubblicato un interessante articolo intitolato ‘Microbiota polmonare: una nuova via da seguire per i trattamenti futuri?’. L’approfondimento scientifico è firmato da Antonella Cotoia, Giuseppe Ferrara, Lucia Mirabella, Gilda Cinnella professori del Dipartimento di Scienze Mediche e Chirurgiche dell’Università di Foggia, struttura organizzativa di ricerca che coordina SAFETY. Ve lo proponiamo integralmente
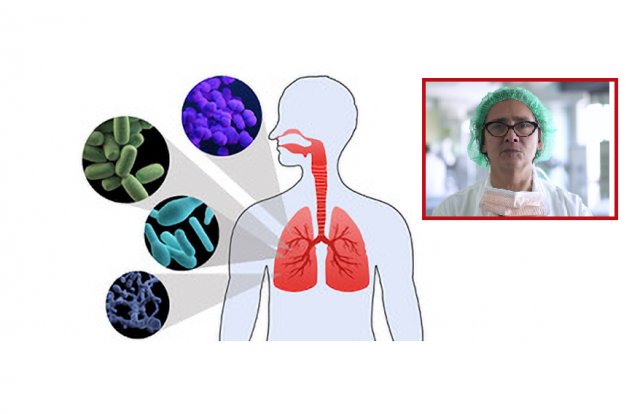
<Il microbiota umano è costituito principalmente da batteri ma comprende anche virus, muffe, lieviti e protozoi che colonizzano la pelle e le mucose delle cavità esposte all’esterno, come il tratto gastrointestinale, respiratorio e genito-urinario. In questi ambienti, il microbiota stabilisce una relazione simbiotica con l’ospite, fornendo una modulazione precoce dello sviluppo fisiologico dell’ospite, delle funzioni nutrizionali, immunitarie e di resistenza ai patogeni in tutte le fasi della vita. [1,2] Pertanto la disbiosi nel microbiota è stata associata a malattie come malattie infiammatorie intestinali, sclerosi multipla, diabete, allergie, asma, autismo e cancro [3, 4, 5, 6, 7].
Inizialmente i polmoni e le vie aeree sono stati omessi dagli organi da studiare perché era diffusa la convinzione che i polmoni sani fossero sterili, ma dati recenti hanno cambiato la teoria sterile dei polmoni: il tratto respiratorio contiene comunità microbiche dalle fosse nasali agli alveoli polmonari, con le più alte concentrazioni riscontrate nelle vie aeree superiori. [8] [9] Questo microbiota autoctono contribuisce alla difesa contro la colonizzazione e l’infezione da parte di agenti patogeni della mucosa respiratoria, prevenendone così la diffusione nel tratto. Quindi, in condizioni sane, il microbiota polmonare è costituito da una comunità transitoria di microrganismi, principalmente dal rinofaringe e dall’orofaringe, che si depositano nei polmoni stabilendo un’apparente omeostasi con l’ospite.[10]
Non è chiaro se i microrganismi presenti nei polmoni siano unici, ma la maggior parte dei dati suggerisce una sostanziale diversità negli individui sani. [11, 12, 13, 14]
Dati recenti hanno anche dimostrato che la presenza di un microbo specifico (es. Treponema Whipplei) nei polmoni di soggetti sani non è stata trovata nei campioni delle vie aeree superiori e l’evidenza che la colonizzazione delle vie aeree inferiori con questo microbo è stata potenziata in stato di immunodeficienza. [15] Questi risultati suggeriscono che i taxa unici potrebbero trovare una nicchia speciale nell’ambiente polmonare ed esercitare un ruolo immunomodulatore. [16]
Anche se il ruolo del microbiota intestinale nel plasmare il sistema immunitario della mucosa è chiaramente compreso, non è chiaro se le associazioni osservate con il microbiota polmonare e il sistema immunitario siano causali o meno. [17, 18]
In caso contrario, esiste una relazione tra microbiota intestinale e polmonare nota come “asse intestino-polmone” e agendo su questa connessione sono allo studio trattamenti farmacologici con probiotici per verificare se i modificatori del microbiota intestinale possono influenzare anche il microbiota polmonare e le patologie polmonari, soprattutto nelle colline critiche. [19,20, 21]
Su questa base, il nostro gruppo di ricerca presso l’Università di Foggia (Italia) mira a studiare gli effetti del trattamento nutrizionale in pazienti traumatici con lesioni cerebrali nell’Unità di Terapia Intensiva sul microbiota polmonare per cercare di capire meglio come questo nuovo trattamento possa influenzare l’esito in questi pazienti specifici.>
Autori: Antonella Cotoia, Giuseppe Ferrara, Lucia Mirabella, Gilda Cinnella – Università di Foggia (Italia)
Riferimenti:
- Gill, SR et al. Analisi metagenomica del microbioma intestinale distale umano. Scienza 312, 1355–1359 (2006). DOI: 10.1126/scienza.1124234
- Dominguez-Bello MG, Godoy-Vitorino F, Knight R, Blaser MJ. Ruolo del microbioma nello sviluppo umano. Intestino. 2019;68:1108—14 https://gut.bmj.com/content/68/6/1108
- Petersen C, Round JL. Definire la disbiosi e la sua influenza sull’immunità e sulla malattia dell’ospite. microbiolo cellulare. 2014;16:1024–33. https://doi.org/10.1111/cmi.12308
- Backhed F, Fraser CM, Ringel Y, Sanders ME, Sartor RB, Sherman PM, et al. Definizione di un microbioma intestinale umano sano: concetti attuali, direzioni future e applicazioni cliniche. Microbo ospite cellulare. 2012;12:611–22.
- Tromba A, Gollwitzer ES, Yadava K, Sichelstiel AK, Sprenger N, Ngom-Bru C, et al. Il metabolismo del microbiota intestinale delle fibre alimentari influenza le malattie allergiche delle vie aeree e l’emopoiesi. Nat Med. 2014;20:159–66. https://doi.org/10.1038/nm.3444
- Hsiao EY, McBride SW, Hsien S, Sharon G, Hyde ER, McCue T, et al. Il microbiota modula le anomalie comportamentali e fisiologiche associate ai disturbi dello sviluppo neurologico. Cellula. 2013;155:1451–63.
- Garrett WS. Cancro e microbiota. Scienza. 2015;348:80–6. 1126/scienza.aaa4972
- Dickson RP, Erb-Downward JR, Huffnagle GB. Il ruolo del microbioma batterico nelle malattie polmonari. Esperto Rev Respir Med 2013;7:245–57. https://doi.org/10.1586/ers.13.24
- Man WH, de Steenhuijsen Piters WA, Bogaert D. Il microbiota delle vie respiratorie: guardiano della salute respiratoria. Nat Rev microbiolo. 2017;15:259-70. https://doi.org/10.1038/nrmicro.2017.14
- . Dickson RP, Erb-Downward JR, Freeman CM, McCloskey L, Beck JM, Huffnagle GB, et al. Variazione spaziale nel microbioma polmonare umano sano e nel modello adattato dell’isola della biogeografia polmonare. Ann Am Thorac Soc. 2015;12:821-30.
- Morris A, Beck JM, Schloss PD, Campbell TB, Crothers K, Curtis JL, Flores SC, Fontenot AP, Ghedin E, Huang L, et al. Confronto del microbioma respiratorio in fumatori e non fumatori sani. Am J Respir Crit Care Med 2013;187:1067–1075
- Segal LN, Alekseyenko AV, Clemente JC, Kulkarni R, Wu B, Chen H, Berger KI, Goldring RM, Rom WN, Blaser MJ, et al. L’arricchimento del microbioma polmonare con i taxa sopraglottici è associato ad un aumento dell’infiammazione polmonare. Microbioma 2013;1:19.
- Hilty M, Burke C, Pedro H, Cardenas P, Bush A, Bossley C, Davies J, Ervine A, Poulter L, Pachter L, et al. Comunità microbiche disordinate nelle vie aeree asmatiche. PLoS One 2010;5:e8578.
- ErbDownward JR, Thompson DL, Han MK, Freeman CM, McCloskey L, Schmidt LA, Young VB, Toews GB, Curtis JL, Sundaram B, et al. Analisi del microbioma polmonare nel fumatore “sano” e nella BPCO. PLoS One 2011;6:e16384.
- Lozupone C, CotaGomez A, Palmer BE, Linderman DJ, Charlson ES, Sodergren E, Mitreva M, Abubucker S, Martin J, Yao G, et al. Colonizzazione diffusa del polmone da parte di Tropheryma whipplei nell’infezione da HIV. Am J Respir Crit Care Med 2013;187:1110–1117.
- Leopoldo N. Segal 1 e Martin J. Blaser , A Brave New World: The Lung Microbiota in an Era of Change https://doi.org/10.1513/AnnalsATS.201306-189MG .
- Ivanov II, Frutos Rde L, Manel N, Yoshinaga K, Rifkin DB, Sartor RB, Finlay BB, Littman DR. Il microbiota specifico dirige la differenziazione delle cellule T helper che producono IL-17 nella mucosa dell’intestino tenue. Microbo ospite cellulare 2008; 4: 337–349. https://doi.org/10.1016/j.chom.2008.09.009
- Atarashi K, Tanoue T, Shima T, Imaoka A, Kuwahara T, Momose Y, Cheng G, Yamasaki S, Saito T, Ohba Y, et al. Induzione di cellule T regolatorie del colon da parte di specie indigene di Clostridium. Scienza 2011;331:337–341. DOI: 10.1126/scienza.1198469
- Mukherjee S, Hanidziar D. Più dell’intestino nel polmone: come due microbiomi si incontrano nell’ARDS. Yale J Biol Med. 2018;91:143–9 Disponibile da: http://www.ncbi.nlm.nih.gov/pubmed/29955219.
- van Ruissen MCE, Bos LD, Dickson RP, Dondorp AM, Schultsz C, Schultz MJ. Manipolazione del microbioma nei probiotici per malattie critiche come misura preventiva contro la polmonite associata al ventilatore. Terapia Intensiva Med Exp. 2019;7:37 Disponibile da http://www.ncbi.nlm.nih.gov/pubmed/31346841.
Weng H, Li JG, Mao Z, Feng Y, Wang CY, Ren XQ, et al. Probiotici per prevenire la polmonite associata al ventilatore in pazienti ventilati meccanicamente: una meta-analisi con analisi sequenziale di prova. Farmaco anteriore. 2017;8:717 Disponibile da http://www.ncbi.nlm.nih.gov/pubmed/29062279
Schema del progetto SAFETY
Simulation Approach For Education and Training in Emergency (SAFETY) è un progetto europeo Erasmus+ (Azione chiave 2) della durata di tre anni volto a valutare il divario tra le conoscenze teoriche e pratiche nel settore della medicina d’urgenza e della simulazione. Il progetto SAFETY è coordinato dal Dipartimento di Scienze Mediche e Chirurgiche, Università di Foggia (Italia).
L’obiettivo del progetto è quello di cooperare nello scambio di conoscenze e buone pratiche per realizzare un percorso di studi nei campi della medicina d’urgenza e della terapia intensiva.
Il progetto SAFETY mira a rinnovare l’offerta formativa esistente e a colmare le lacune formative, rendendo i professionisti più sicuri e pronti ad operare in condizioni di reale emergenza o collaborare con aziende coinvolte nello sviluppo di strumenti di simulazione medica.